简介


CE认证是医疗器械产品在欧洲成员国市场内自由流通的“通行证”。欧盟MDD 93/42/EEC指令要求以及最新的MDR医疗器械法规要求,生产商必须提供一份文件,来证明预期目的和有关安全和性能的要求已经实现。作为基本要求,制造商必须使用临床数据来证明器械符合相关的基本要求。而《CE临床评价指南》正是对何时进行临床评价、如何进行临床评价、临床评价应详尽到什么程度等问题进行了阐释与指导。
目前临床评价的指南文件MEDDEV 2.7/1 修订第 4 版已于 2016 年 6 月发布。MEDDEV 2.7/1 修订第 4 版虽不具有法律约束力,但它是由所有利益相关者参与制定,反映了医疗器械临床评价领域的最佳实务 (State of Art) ,此外对于具有法律约束力的医疗器械指令 93/42/EEC 中所述的简明要求,MEDDEV 2.7/1 修订第 4 版则提供了最佳的解释。在这一指令背景下,欧盟公告机构/主管当局对于制造商技术文件中的临床评价资料也将愈加关注。
对于想要打开欧洲市场的医疗器械企业来说,了解学习《CE临床评价指南》,学会进行临床评价及撰写临床评价报告则是其立足于市场不可或缺的一步。而这正需要合格的CE临床评价工程师,充分了解指南文件,了解如何进行临床评价,如何通过引用标准、搜索文献和检索临床数据编写临床评价资料,指导和帮助企业完成相关的符合性评估产品认证。
医械企业——临床评价合规产品认证顺利完成
学员个人——临床评价专业知识助力职业成长
深圳市龙德生物科技有限公司与深圳市龙德先进医疗器械质量技术管理研究所携手旗下讲师团队,结合多年的医疗器械行业经验及CE临床评价经验,历经一年多的设计和研发,倾情打造包含二十多个子课程的系列课程--《医疗器械CE临床评价工程师研修系列课》。


(1)产品经理和总策划人 Oscar Young 深圳市龙德生物科技有限公司 首席运营官 医械行业资深顾问
(2)讲师 Lyric Xia 深圳市龙德生物科技有限公司 注册咨询事业部经理 资深高级讲师 (3)讲师 Nevin Wang 深圳市龙德生物科技有限公司 临床工程师
(4)讲师 Ben Wang 深圳市龙德生物科技有限公司 注册工程师
(5)讲师 Sophie Zhao 深圳市龙德生物科技有限公司 注册工程师
目标学员:
医疗器械CE临床工作的相关人员:CE临床评价工程师、CE临床认证工程师、临床工程师、注册工程师、标准和法规工程师、项目经理、研发工程师、管理者代表、质量部人员、法规人员、技术开发人员、设计管理人员。以及对于医疗器械CE临床评价感兴趣的人员、高校师生、医疗器械创业者、高管、医院的医疗器械临床试验管理人员等。
- 1
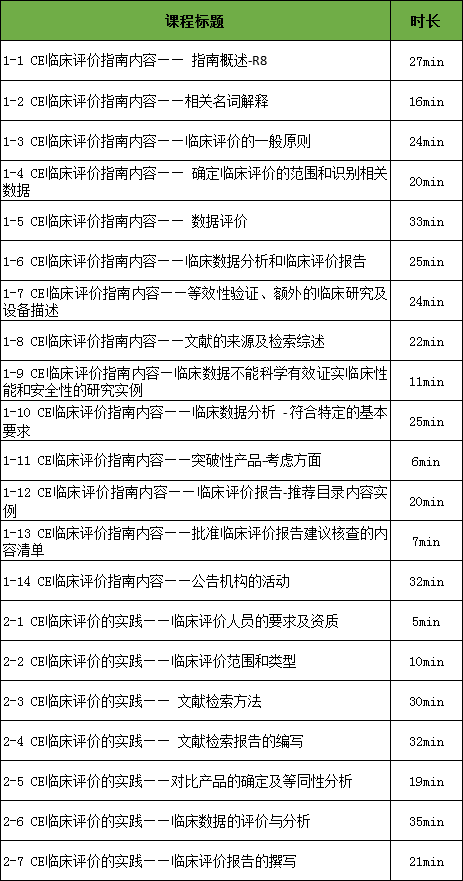
1-1 CE临床评价指南内容—— 指南概述-R8
446次学习 - 2
1-2 CE临床评价指南内容——相关名词解释
293次学习 - 3
1-3 CE临床评价指南内容——临床评价的一般原则
251次学习 - 4
1-4 CE临床评价指南内容—— 确定临床评价的范围和识别相关数据
203次学习 - 5
1-5 CE临床评价指南内容—— 数据评价
188次学习 - 6
1-6 CE临床评价指南内容——临床数据分析和临床评价报告
176次学习 - 7
1-7 CE临床评价指南内容——等效性验证、额外的临床研究及设备描述
128次学习 - 8
1-8 CE临床评价指南内容——文献的来源及检索综述
182次学习 - 9
1-9 CE临床评价指南内容—临床数据不能科学有效证实临床性能和安全性的研究实例
68次学习 - 10
1-10 CE临床评价指南内容——临床数据分析 - 符合特定的基本要求
131次学习 - 11
1-11 CE临床评价指南内容——突破性产品-考虑方面
65次学习 - 12
1-12 CE临床评价指南内容——临床评价报告-推荐目录内容实例
148次学习 - 13
1-13 CE临床评价指南内容——批准临床评价报告建议核查的内容清单
66次学习 - 14
1-14 CE临床评价指南内容——公告机构的活动
70次学习 - 15
2-1 CE临床评价的实践——临床评价人员的要求及资质
55次学习 - 16
2-2 CE临床评价的实践——临床评价范围和类型
53次学习 - 17
2-3 CE临床评价的实践—— 文献检索方法
149次学习 - 18
2-4 CE临床评价的实践—— 文献检索报告的编写
116次学习 - 19
2-5 CE临床评价的实践——对比产品的确定及等同性分析
66次学习 - 20
2-6 CE临床评价的实践——临床数据的评价与分析
74次学习 - 21
2-7 CE临床评价的实践——临床评价报告的撰写
132次学习 - 22
旧18年录 CE临床评价指南内容——等效性验证、额外的临床研究及设备描述
162次学习 - 23
旧19年录 2-1 CE临床评价的实践——临床评价人员的要求及资质
142次学习
茉莉萱草
2018.11.02大失所望讲得很乏味1-8 CE临床评价指南内容——文献的来源及检索综述莫日光
2018.10.10大失所望照读PPT,未能展开讲1-6 CE临床评价指南内容——临床数据分析和临床评价报告莫日光
2018.10.10大失所望授课老师只是照读PPT,未能展开讲,感觉没什么收获1-4 CE临床评价指南内容—— 确定临床评价的范围和识别相关数据

